Chronisch
myeloproliferative
Erkrankungen
Dr. Sormann Siegfried
Jakavi
Zulassung
Jakavi ist angezeigt für die Behandlung von krankheitsbedingter Splenomegalie oder Symptomen bei Erwachsenen mit primärer Myelofibrose(auch bekannt als chronische idiopathische Myelofibrose),Post-Polycythaemia-vera-Myelofibrose oderPost-Essentieller-Thrombozythämie-Myelofibrose.und für die Behandlung von Erwachsenen mit Polycythaemia vera,die resistent oder intolerant gegenüberHydroxycarbamid sind
Dosierung
Die maximale Dosis von Ruxolitinib beträgt 25 mg zweimal täglich.
MF beträgt 15mg zweimal täglich bei Patienten mit einer Thrombozytenzahl zwischen 100.000/mm3 und 200.000/mm3und zweimal täglich 20mg bei Patienten mit einer Thrombozytenzahl >200.000/mm3.
Die empfohlene Anfangsdosis von Ruxolitinib bei PV beträgt 10mg oral zweimal täglich.
Wirkmechanismus
Bindung an hauptsächlich an JAK2 und auch an JAK1. JAK1 vermittelt eine proinflammatorische Antwort auf die Bindung von inflammatorischen Zytokinen: IL1,IL6,TNFa - daher hat auch Jakavi über die Hemmung von JAK1 eine antiinflammatorische Wirkung.
JAK2 vermittelt das Signal von EPO,GM-CSF,TPO,IL3;IL5;Wachstumshormon,Prolactin.
Bei PMF finden sich erhöhte Spiegel an proinflammatorischen Zytokinen - Symptome MMA, Fieber, KGWabnahme.. ; Besserung der Symptome unter Jakavi

Affinität der verschiedenen JAK zu den entsprechenden Zytokinen bzw.Rezeptoren 
Dosisanpassung
Bei einer Thrombozytenzahl von weniger als 50.000/mm3oder einer absoluten Neutrophilenzahl von weniger als 500/mm3sollte die Behandlung unterbrochen werden. Auch bei PV sollte die Behandlung unterbrochen werden, wenn der Hämoglobinwert unter 8g/dl liegt.
Wenn die Thrombozytenzahl unter 100.000/mm3 fällt, sollte eine Dosisreduktion in Erwägung gezogen werden, um eine Unterbrechung der Dosierung aufgrund einer Thrombozytopenie zu vermeiden. Auch bei PV sollte eine Dosisreduktion in Erwägung gezogen werden, wenn der Hämoglobinwert unter 12 g/dl sinkt; eine Dosisreduktion wird bei einem Absinken des Hämoglobinwerts unter 10 g/dl empfohlen.
starken CYP3A4-Hemmern oder dualen Inhibitoren von CYP2C9- und CYP3A4-Enzymen (z. B. Fluconazol) gegeben wird, sollte die Einzeldosis von Ruxolitinib, die zweimal täglich gegeben wird, um etwa 50% verringert werden
Nierenfunktion
Bei Patienten mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance weniger als 30 ml/min) sollte die auf der Thrombozytenzahl basierende empfohlene Anfangsdosis für MF-Patienten, die zweimal täglich gegeben wird, um etwa 50% verringert werden. Die empfohlene Anfangsdosis für PVPatienten mit schwerer Nierenfunktionsstörung beträgt 5 mg zweimal täglich
Hämodialyse-Patienten mit ESRD nur am Tag der Dialyse eine Einzeldosis von 15 bis 20 mg oder zwei Dosen mit jeweils 10 mg im Abstand von 12 Stunden nach Beendigung der Dialyse gegeben werden sollten.
Als Anfangsdosis wird bei PV für Hämodialyse-Patienten mit ESRD eine Einzeldosis von 10 mg oder zwei Dosen mit jeweils 5 mg im Abstand von 12 Stunden empfohlen; diese Dosen sollten nach der Dialysesitzung und nur an Dialysetagen gegeben werden.
Leberfunktion
Bei Patienten mit jeglicher Leberfunktionsstörung sollte die auf der Thrombozytenzahl basierende empfohlene Anfangsdosis, die zweimal täglich gegeben wird, um etwa 50% verringert werden.
Behandlungsende
nach 6 Monaten beendet werden, falls es zu keiner Reduktion der Milzgröße oder Verbesserung der Symptome seit dem Beginn der Therapie gekommen ist
Infektionen
Schwerwiegende bakterielle, mykobakterielle, fungale, virale und andere opportunistische Infektionen sind bei Patienten, die mit Jakavi behandelt wurden, aufgetreten.
die Jakavi erhielten, wurde über Tuberkulose berichtet. Dies kann gegebenenfalls die Anamnese, mögliche frühere Kontakte mit einer Tuberkulose und/oder geeignete Untersuchungen wie Röntgenaufnahmen der Lunge, Tuberkulin-Test und/oder einen Interferon-Gamma-Release-Assay beinhalten
Die Wirkung von Jakavi auf die Virusreplikation bei Patienten mit chronischer HBV-Infektion ist nicht bekannt. Patienten mit chronischer HBV-Infektion sollten den klinischen Leitlinien entsprechend behandelt und überwacht werden.
Herpes-zoster-Infektion aufklären
sonstige NW
Progressive multifokale Leukenzephalopathie (PML) wurde bei der Behandlung mit Jakavi berichtet.
Die Behandlung mit Jakavi wurde mit Anstiegen der Lipidparameter, einschließlich Gesamtcholesterin, HDL(high-density lipoprotein)-Cholesterin, LDL(low-density lipoprotein)Cholesterin und Triglyceriden, in Verbindung gebracht. Die Überwachung der Serumlipide und die Behandlung von Dyslipidämie gemäß klinischer Leitlinien werden empfohlen.
Absetzreaktion
Nach Unterbrechung oder Absetzen der Behandlung mit Jakavi kann es etwa innerhalb einer Woche zu einem erneuten Auftreten von MF-Symptomen kommen. Es existieren Fallberichte von Patienten, die, besonders bei Anwesenheit einer akuten interkurrenten Erkrankung, bei Abbruch der Behandlung mit Jakavi schwerere Ereignisse erlitten. Bisher ist nicht bekannt, ob das abrupte Absetzen von Jakavi zu diesen Ereignissen beigetragen hat. Falls kein sofortiges Absetzen notwendig ist, sollte ein stufenweises Ausschleichen der Jakavi-Dosis in Betracht gezogen werden, auch wenn der Nutzen des Ausschleichens nicht bewiesen ist.
Wechselwirkungen
CYP3A4-Inhibitoren Starke CYP3A4-Inhibitoren (wie z. B., aber nicht begrenzt auf, Boceprevir, Clarithromycin, Indinavir, Itraconazol, Ketoconazol, Lopinavir/Ritonavir, Ritonavir, Mibefradil, Nefazodon, Nelfinavir, Posaconazol, Saquinavir, Telaprevir, Telithromycin, Voriconazol). Die Halbwertszeit wurde durch die gleichzeitige Anwendung von Ketoconazol von 3,7 auf 6,0 Stunden verlängert
duale Inhibitoren von CYP2C9- und CYP3A4-Enzymen sind (z. B. Fluconazol), sollte eine 50%ige Dosisreduktion in Betracht gezogen werden. Die gleichzeitige Anwendung von Ruxolitinib mit Fluconazol-Dosen von mehr als 200 mg täglich ist zu vermeiden.
CYP3A4-Induktoren (wie z. B., aber nicht beschränkt auf, Avasimib, Carbamazepin, Phenobarbital, Phenytoin, Rifabutin, Rifampin (Rifampicin), Johanniskraut (Hypericum perforatum)) Ruxolitinib um 70% niedriger
Schwache bis mäßig wirksame CYP3A4-Inhibitoren (wie z. B., aber nicht beschränkt auf, Ciprofloxacin, Erythromycin, Amprenavir, Atazanavir, Diltiazem, Cimetidin) Erhöhung der Cmax und der AUC von Ruxolitinib um 8% bzw. um 27%
Ruxolitinib kann das P-Glykoprotein und das Breast Cancer Resistance Protein (BCRP) im Darm hemmen. Daraus resultiert möglicherweise eine erhöhte systemische Exposition von Substraten dieser Transporter, wie Dabigatranetixilat, Ciclosporin, Rosuvastatin und potenziell Digoxin
Anwendung Myelofibrose
COMFORT-I und COMFORT-II
COMFORT-I war eine randomisierte, placebokontrollierte Doppelblindstudie mit 309 Patienten, die auf eine verfügbare Therapie nicht ansprachen oder für diese nicht in Frage kamen
COMFORT-II war eine nicht-verblindete, randomisierte Studie mit 219 Patienten. Die Patienten wurden im Verhältnis 2:1 zu einer Behandlung mit Ruxolitinib im Vergleich mit der besten verfügbaren Therapie randomisiert
In COMFORT-II lag, nach einer medianen Nachbeobachtungszeit von 34,7 Monaten, die Sterberate bei Patienten, die in den Ruxolitinibarm randomisiert wurden, bei 19,9% gegenüber 30,1% bei Patienten, die in den Behandlungsarm mit der besten verfügbaren Therapie (BAT) randomisiert wurden; HR 0,48; 95%-KI 0,28-0,85; p=0,009. In beiden Studien basierten die niedrigeren Sterberaten, die im Ruxolitinibarm beobachtet wurden, hauptsächlich auf den Ergebnissen, die in den Post-Polycythaemia-vera- und Post-Essentielle-Thrombozythämie-Subgruppen gewonnen wurden.
 |
Anwendung PRV
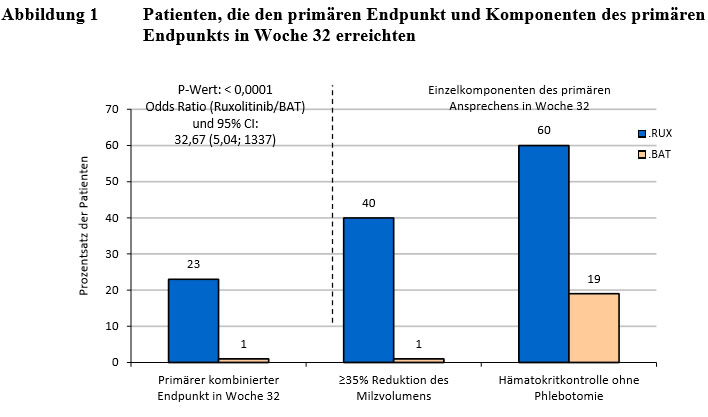
Response I II(ohne Splenomegalie
Eine randomisierte, nicht-verblindete, aktiv kontrollierte Phase-III-Studie (RESPONSE) wurde mit 222 Patienten mit PV durchgeführt, die eine Resistenz oder Unverträglichkeit gegenüber Hydroxycarbamid aufwiesen.
Eine zweite randomisierte, nicht-verblindete, aktiv kontrollierte Phase-IIIb-Studie (RESPONSE 2) wurde mit 149 Patienten mit PV durchgeführt, die eine Resistenz oder Unverträglichkeit gegenüber Hydroxycarbamid aufwiesen, aber keine tastbare Vergrößerung der Milz hatten
Der wichtigste sekundäre Endpunkt, der definiert war als der Anteil der Patienten, die eine vollständige hämatologische Remission in Woche 28 aufwiesen, wurde ebenfalls erreicht (23,0% im Jakavi-Arm gegenüber 5,3% im BAT-Arm).
 |
