Chronisch
myeloproliferative
Erkrankungen
Dr. Sormann Siegfried
pegyliertes Interferon
Zulassung
chronisch myeloproliferative Erkrankungen
Dosierung
Start mit 90ug 1x/Woche sc. für 2 Wochen - dann bis zur maximalen tolerierten Dosis auf 180ug.
Wirkmechanismus
35 von 37 Patienten - ChaemR; 7 molekulare Remission - JAK2 nicht mehr nachweisbar.Besremie
Ropeginterferon alfa-2b
Zulassung
Besremi ist als Monotherapie indiziert zur Behandlung von erwachsenen Patienten mit einerPolycythaemia vera ohne symptomatische Splenomegalie
Dosierung
Titrationsphase
Die Dosis wird individuell gesteigert, wobei die empfohlene Anfangsdosis 100 Mikrogramm (bzw. 50 Mikrogramm bei Patienten unter einer anderen zytoreduktiven Therapie) beträgt. Die Dosis sollte schrittweise alle zwei Wochen um 50 Mikrogramm erhöht werden (parallel sollte, soweit möglich, die schrittweise Reduktion der anderen zytoreduktiven Therapie erfolgen), bis eine Stabilisierung der hämatologischen Parameter erzielt wird (Hämatokrit < 45 %, Thrombozyten < 400 x 109/l und Leukozyten < 10 x 109/l). Die maximale empfohlene Einzeldosis beträgt 500 Mikrogramm alle zwei Wochen.
Kontraindikation
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile• Vorbestehende Schilddrüsenerkrankung, sofern sie nicht mit konventioneller Behandlung kontrolliert werden kann• Bestehende oder in der Vorgeschichte aufgetretene schwere psychiatrische Störungen, insbesondere schwere Depression, Suizidgedanken oder Suizidversuch• Schwere vorbestehende kardiovaskuläre Erkrankung, (d.h. unkontrollierte Hypertonie, kongestive Herzinsuffizienz (≥ NYHA-Klasse 2), schwerwiegende kardiale Arrhythmie, signifikante Koronararterienstenose, instabile Angina pectoris) oder Schlaganfall bzw.Myokardinfarkt in der jüngsten Vergangenheit• Vorgeschichte oder Bestehen einer Autoimmunerkrankung• Immunsupprimierte Transplantatempfänger• Kombination mit Telbivudin (siehe Abschnitt 4.5)• Dekompensierte Leberzirrhose (Child-Pugh B oder C)• Terminale Niereninsuffizienz (GFR < 15 ml/min
Wirkung - Studie
Phase-III-Studie (PROUD-PV) wurde die Wirksamkeit und Sicherheit von Ropeginterferon alfa-2b im Vergleich mit Hydroxycarbamid bei 254 erwachsenen Patienten mit Polycythaemia vera

 |
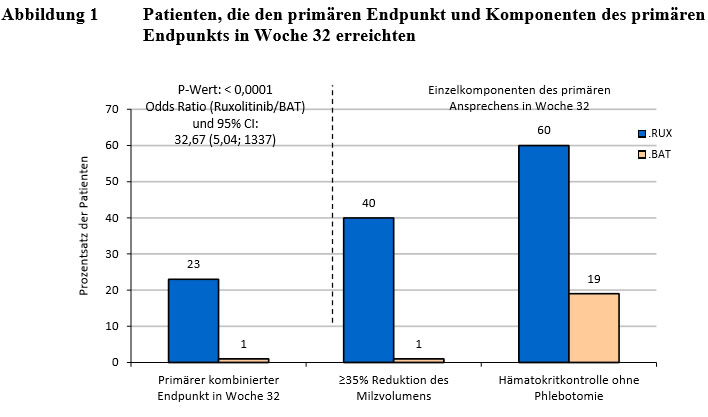
Anwendung PRV
Response I II(ohne Splenomegalie
Eine randomisierte, nicht-verblindete, aktiv kontrollierte Phase-III-Studie (RESPONSE) wurde mit 222 Patienten mit PV durchgeführt, die eine Resistenz oder Unverträglichkeit gegenüber Hydroxycarbamid aufwiesen.
Eine zweite randomisierte, nicht-verblindete, aktiv kontrollierte Phase-IIIb-Studie (RESPONSE 2) wurde mit 149 Patienten mit PV durchgeführt, die eine Resistenz oder Unverträglichkeit gegenüber Hydroxycarbamid aufwiesen, aber keine tastbare Vergrößerung der Milz hatten
Der wichtigste sekundäre Endpunkt, der definiert war als der Anteil der Patienten, die eine vollständige hämatologische Remission in Woche 28 aufwiesen, wurde ebenfalls erreicht (23,0% im Jakavi-Arm gegenüber 5,3% im BAT-Arm).
 |
